發布時間:2025-11-03
中國科學院廣州生物醫藥與健康研究院(以下簡稱“廣州健康院”)納米轉化醫學研究組和華中科技大學協和醫院孫家明教授團隊近期聯合在 Materials Today Bio發表了題為 “Aerogel library with varying porous structures and mechanics regulates motor neuron progenitor differentiation for spinal cord injury repair” 的研究論文。該研究構建了一種微納結構與力學性能可調控的多孔氣凝膠庫,揭示了仿生三維微環境的孔隙結構與力學強度對人源誘導多能干細胞(hiPSCs)來源的運動神經前體細胞(MNPs)譜系命運調控作用和關鍵分子機制,并驗證了其在脊髓損傷修復中的功能再生潛力。
在脊髓損傷微環境中,外源細胞移植常面臨生存率低、分化譜系不穩定和功能整合效率不足等挑戰。針對這些問題,研究團隊通過精確調控氣凝膠支架的孔徑分布(范圍10–100 μm)與彈性模量(范圍0.1–1.0 kPa),獲得一系列具有不同拓撲結構及力學特性的三維仿生凝膠。研究發現,孔徑20 μm且模量0.4 kPa的仿生支架適配MNPs存活、軸突定向生長及ChAT+運動神經元(MNs)分化,揭示了物理微環境在干細胞調控神經分化過程中的主導作用。機制研究顯示,仿生材料可通過激活Yes相關蛋白(YAP)的核轉位驅動MNs分化,而抑制YAP信號則會阻斷該促進作用,進一步證實YAP介導的機械信號感應是該仿生體系調控MNs命運的關鍵途徑。
該研究證實,仿生凝膠通過微納結構與力學性能的協同調控,在脊髓損傷區域有效招募宿主內皮細胞并顯著抑制炎癥級聯反應。通過重塑支持神經發生的微環境,顯著提高了移植MNP的存活率及功能性MN的定向分化與成熟。此外,仿生凝膠進一步通過促進脊髓組織結構的重建,從而支持局部神經環路的恢復,并最終顯著改善了脊髓損傷小鼠的后肢運動功能。該研究為脊髓損傷修復領域提供了一種結合仿生材料與細胞治療的協同新策略。
廣州健康院巫林平研究員和華中科技大學協和醫院孫家明教授為該論文的共同通訊作者,侯金飛博士、揭君津博士和張迪博士為共同第一作者。研究項目得到了國家重點研發計劃、國家自然科學基金、廣州市科技重點研發項目以及廣東省重大人才工程項目等經費的支持。
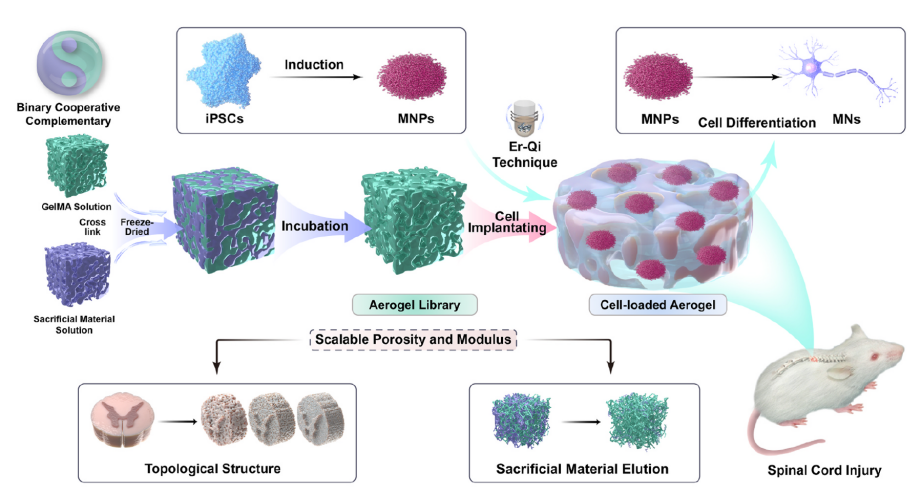
圖1?具有不同多孔結構和力學性能的氣凝膠庫調控運動神經元分化的研究示意圖
附件下載:

